酵素阻害速度式 動力学パラメーター KmとVmaxの意味 阻害剤と酵素活性への影響
強く結合する阻害剤 付録 pdfファイルの



|
酵素阻害速度式 動力学パラメーター KmとVmaxの意味 阻害剤と酵素活性への影響 強く結合する阻害剤 付録 pdfファイルの 
|
阻害剤(inhibitors)は酵素と相互に作用し,その反応効率を低下させる合成物または天然に存在する化合物である1)。それらは代謝反応速度をコントロールするための医薬品として用いられたり(医薬品の47%は酵素阻害剤),酵素反応機構を理解するための道具としても用いられる。多くの有毒な化合物は酵素阻害剤で,生体に大きな影響を与えるため,抗生物質,農薬,除草剤などに使われている。一方,天然の生理的な阻害剤は生体調節や生体防御等のために働いている。阻害剤は異なる機構で酵素と相互作用するが,酵素反応速度論はこれらの機構を区別することのできる重要な手段となる。ここでは阻害機構の特徴や酵素反応速度式を導出し,さらに,阻害定数(解離定数)Kiを決定する方法を述べる。
1) Copeland, R. A., "Evaluation of Enzyme Inhibitors in Drug Discovery:
A Guide for Medicinal Chemists and Pharmacologists." Wiley-Interscience,
2005.
| 以下の解説では次の略号を使用する。 | ||
| E 酵素 | S 基質 | ES 酵素・基質複合体 |
| I 阻害剤 | EI 酵素・阻害剤複合体 | P 生成物 |
| [E] 全酵素濃度 | [E]f 遊離の酵素濃度 | [ES] 酵素・基質複合体濃度 |
| [S] 基質初濃度 | [S]f 遊離の基質濃度 | k 反応速度定数 |
| Km ミカエリス定数 | Vmax 最大反応速度 | Ki 阻害定数(EIの解離定数) |
|
|
|
 ――ミカエリス・メンテンの式 ――ミカエリス・メンテンの式 |
|
|
|
|
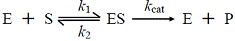 |
(1.1) |
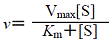 |
(1.2) |
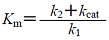 |
(1.3) |
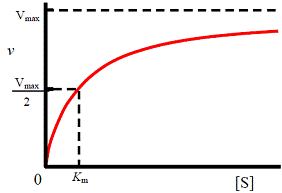
|
|
|
 |
|
|
|
|
 |
(2.1) |
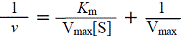 |
(2.2) |
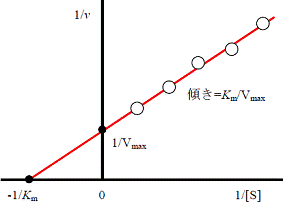
 |
(2.3) |
|
|
|
 |
|
|
|
|
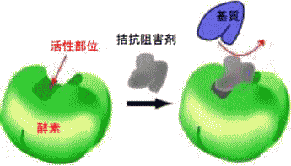
 阻害の形式
阻害の形式
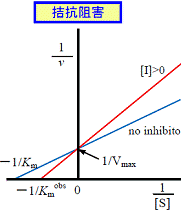
| 拮抗阻害(Competitive Inhibition) | ||
| ・阻害剤は基質と同じ部位に結合する阻害形式である。 ・基質と阻害剤が活性部位を競って結合するため,Km値は大きくなるが,Vmaxは変化しない。 |
 |
|
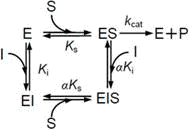
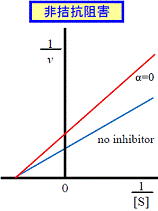
| 非拮抗阻害(Non-competitive Inhibition) | ||
| ・阻害剤が活性部位とは異なる部位に結合して酵素の立体構造を変え,基質が生成物に変わるのを抑える阻害形式である。また、酵素基質複合体(ES)にも結合して阻害するため,基質濃度を高くしても阻害は解消されない。 ・Vmaxが低下するが,阻害剤は直接活性部位に結合しないため基質の親和性に変化がなく,Km値は変化しない。 |
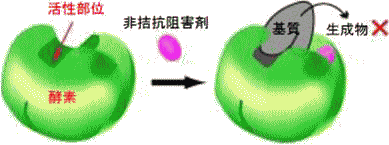 |
|
| 不拮抗阻害(Uncompetitive Inhibition) | ||
| ・阻害剤が遊離の酵素とは結合せず,酵素基質複合体(ES)とだけ結合するような阻害形式である。 ・Km値とVmaxは両方とも変化する。 |
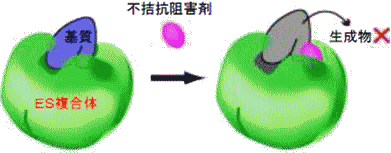 |
|
| 図3 酵素の阻害の仕組み | ||
| これらを式で示すと,図4のようになる。反応速度はそれぞれ右の式ようになる | |||
| 拮抗阻害 | |||
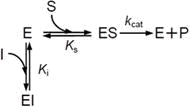 |
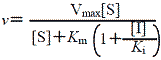 |
(3.1) | |
| 非拮抗阻害 | |||
 |
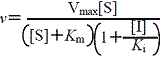 α=1の場合 α=1の場合 |
(3.2) | |
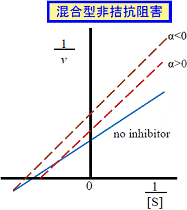
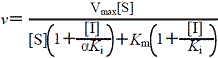 α<>1の場合。これを混合型非拮抗阻害(Mixed non-competitive inhibition)という。 |
(3.3) | ||
| 不拮抗阻害 | |||
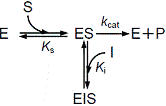 |
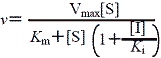 |
(3.4) | |
| 図4 酵素阻害のスキーム(左)と反応速度式(右) | |||
 Lineweaver-Burkプロットによる阻害様式の決定――弱い阻害剤に適用
Lineweaver-Burkプロットによる阻害様式の決定――弱い阻害剤に適用
| 拮抗阻害 | 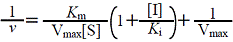 |
不拮抗阻害 | 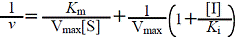 |
| 非拮抗阻害 | 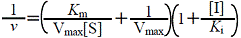 |
混合型 | 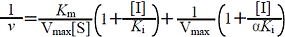 |
| 拮抗および非拮抗阻害ではLineweaver-Burkプロットの直線の傾きが大きくなるが,不拮抗阻害の場合は変化しない(表1)。阻害剤のあるなしでの直線の交点は次のような特徴がある(図5も参照)。 | |||
| 拮抗阻害 | 非拮抗阻害 α=0 |
混合型非拮抗阻害 | 不拮抗阻害 | |
| α>0 | α<0 | |||
| Y軸上 | X軸上 | X軸の上方 | X軸の下方 | 平行 |
 |
 |
 |
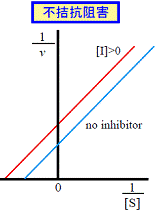 |
| 図5 Lineweaver-Burkプロットによる阻害様式の判定 | |||
 見かけのKm(Kmobs)からのKiの計算
見かけのKm(Kmobs)からのKiの計算
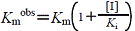 |
(3.5) |
| 2)Dixon, M., The Determination of Enzyme Inhibitor Constants. Biochem. J., 55, 170-171 (1953); Dixon, M., The graphical determination of Km and Ki. Biochem. J., 129, 197-202 (1972); Cornish-Bowden, A Simple Graphical Method for Determining the Inhibition Constants of Mixed, Uncompetitive and Non-Competitive Inhibitors. Biochem. J., 137, 143-144 (1974). | |
 Dixonプロットによる可逆的阻害剤のKi値の決定
Dixonプロットによる可逆的阻害剤のKi値の決定
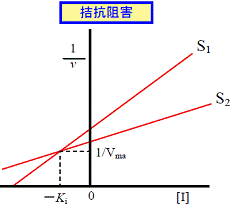
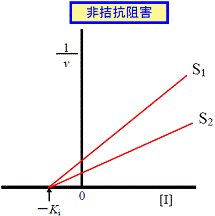
| ●1/vと[I]でプロット ここで,S1<S2 | ||
 |
 |
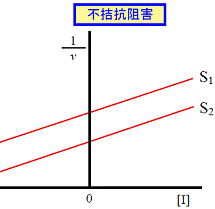 |
| 図6A DixonプロットによるKi値の決定: 1/vと[I]でプロット | ||
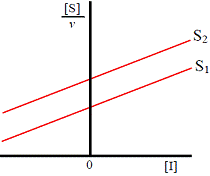
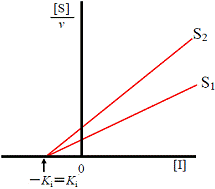
| ●[S]/vと[I]でプロット | ||
 |
 |
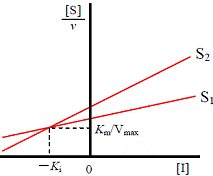 |
| 図6B DixonプロットによるKi値の決定: [S]/vと[I]でプロット | ||
|
|
|
 (tight binding inhibitors) |
|
|
|
|
 強く結合する阻害剤のKi値の決定
強く結合する阻害剤のKi値の決定
| (4.1) Morrisonの式 | ||
| 3)Morrison, J.F., Kinetics of the reversible inhibition of enzyme-catalysed reactions by tight-binding inhibitors. Biochim Biophys Acta, 185, 269-286 (1969) | ||
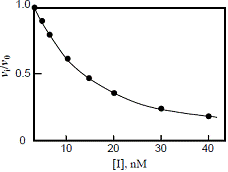 |
|
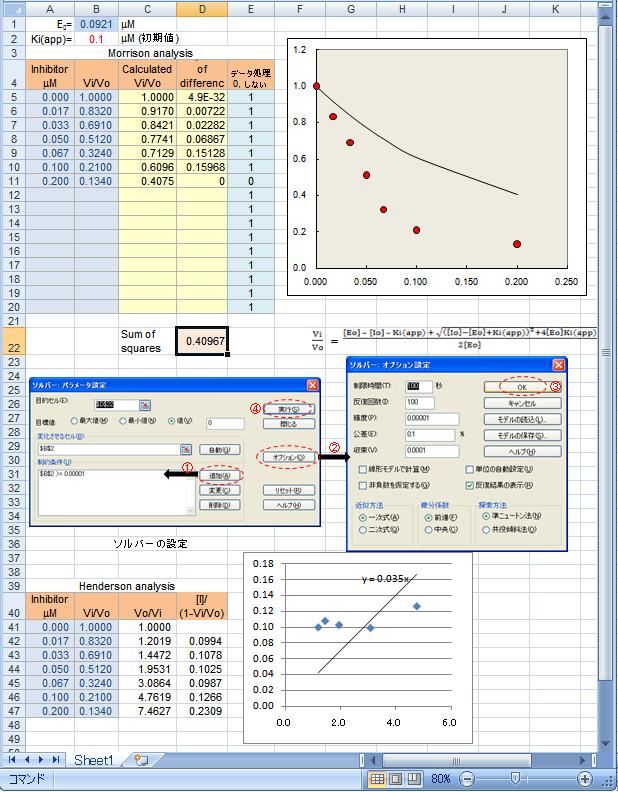
| 図7 Morrisonの式を用いるcurve-fitting |
| 拮抗阻害: | 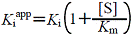 |
(4.2) | |
| 非拮抗阻害: | 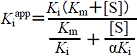 |
(4.3) ここで,α=1ならば, 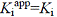 |
|
| 不拮抗阻害: | 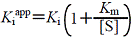 |
(4.4) |
 Hendersonプロット
Hendersonプロット
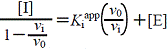 |
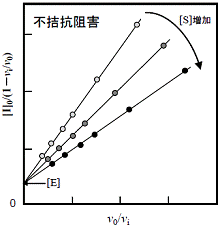
(4.5) | 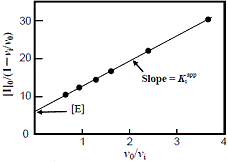 図8 Hendersonプロット |
|
| 4)Henderson, P. J. F., A linear equation that describes the steady-state kinetics of enzymes and subcellular particles interacting with tightly bound inhibitors. Biochem. J., 127, 321-333 (1972). | |||
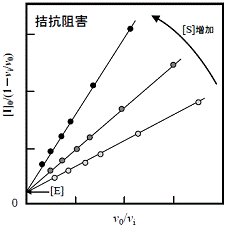 |
 |
|
| 図9 Hendersonプロットによる阻害様式の判定 | ||
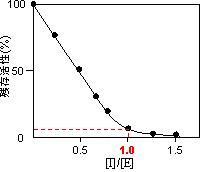
 解離平衡定数を用いるKiの簡便測定法
解離平衡定数を用いるKiの簡便測定法
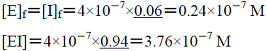
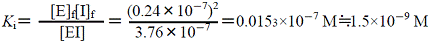
 |
|
| 図10 解離平衡定数を用いる方法 |
|
|
|
 |
|
|
|
|
 非線形解析法による見かけのKi(Kiapp)の計算
非線形解析法による見かけのKi(Kiapp)の計算
 Excelを使った計算例。
Excelを使った計算例。

|