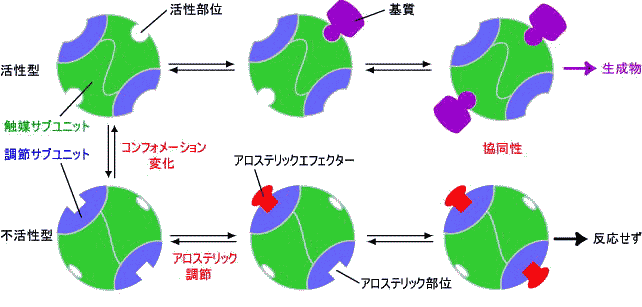
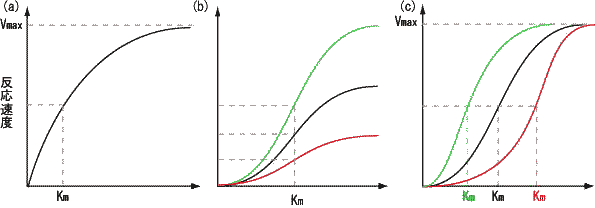
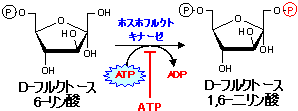
|
|
��1 |
|
��cat |
|
|
|
�d �{ �r |
 |
�d�r |
 |
�d �{ �o |
�i�P�j |
|
|
��2 |
|
| �d�r�̐������x�́A |
|
��[�d�r�n
���� |
����1�m�d][�r�n�|�i��2�{��cat�j[�d�r�n |
�i�Q�j |
| �y�f����ъ�̏��Z�x���m�d�n0�A�m�r�n0�Ƃ���ƁA |
|
�m�d�n0���m�d�n�{�m�d�r�n |
�i�R�j |
|
�m�r�n0���m�r�n�{�m�d�r�n�{�m�o�n |
�i�S�j |
| �ʏ�̎��������ł́m�r�n0��m�d�n0�ł���A�����̏������Ƃ�C�������𗦂�10���ȉ��̏ꍇ�́C�m�o�n�͖����ł��邩��A |
|
�m�r�n0���m�r�n |
�i�T�j |
�Ƃ��Ă悢�B
�܂��A�����̂��������ȊO�́A�m�d�r�n�̔Z�x�ω��͂Ȃ��ƍl���ėǂ��i����ԋߎ��j�̂ŁA�i�Q�j���A�i�R�j���A�i�T�j�����A |
|
��[�d�r]
���� |
����1([�d]0�|[�d�r])[�r]0�|(��2�{��cat)[�d�r]���O�@�@�i�U�j |
| ������܂Ƃ߂�ƁA |
|
[�d�r]�� |
��1�m�d]0�m�r]0
��1�m�r]0�{��2�{��cat
�@ |
|
|
|
�� |
�@�@�@�m�d]0�m�r]0
�m�r]0�{(��2�{��cat)/��1 |
�i�V�j |
|
|
|
|
|
|
| �������x �� �́A |
|
�� �� ��cat�m�d�r�n |
�i�W�j |
|
| ������i�V�j���ɑ�����āA |
|
�� �� |
��cat�m�d]0�m�r]0
�m�r]0�{�jm |
�i�X�j |
|
| ������ �jm �̓~�J�G���X�萔�ŁA�����ŗ^������B |
|
�jm �� |
��2 �{��cat
��1 |
�i10�j |
|
| ���܁A�m�r�n��jm �̏������l����ƁA�i�X�j�����A |
|
�� �� |
��cat�m�d]0 |
�i11�j |
|
�ƂȂ�A�������x�́m�r]0 �Ɉˑ������O�������ƂȂ�B
���̎��� �� �� �umax �Ƃ���ƁA |
|
�umax�� |
��cat�m�d]0 |
�i12�j |
|
�ƂȂ�B�y�f�Z�x�����̏����ő��肷��A�umax�͒萔�ƂȂ�B
�]���āA�i�X�j���͎��̂悤�ɏ��������ł���B |
|
�� �� |
�umax�m�r]0
�m�r]0�{�jm |
�i�~�J�G���X�E�����e���̎��j �i13�j |
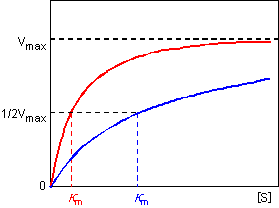
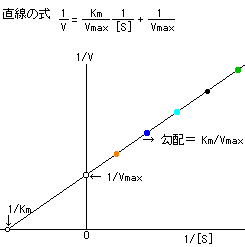
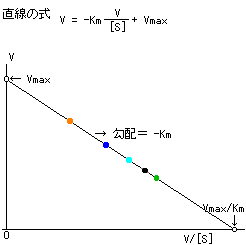
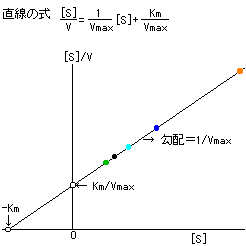
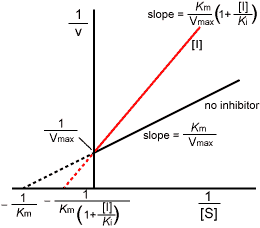
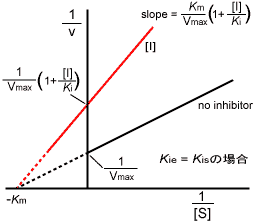
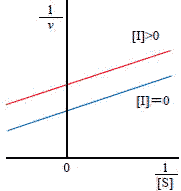
| �@��Z�x�Ɣ������x�̊W��}�Ŏ����ƁC���̂悤�ɂȂ�B |
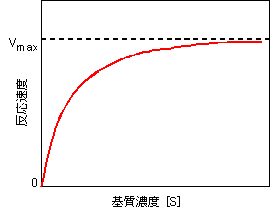 |
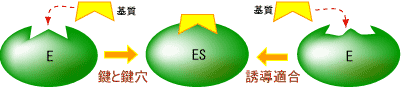
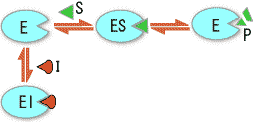
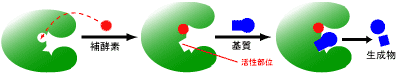
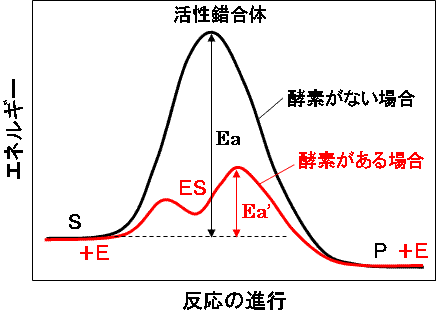
 ES
ES 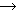 E + P
E + P �@
�@

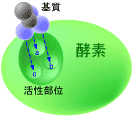
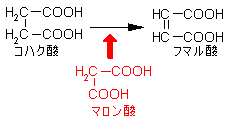
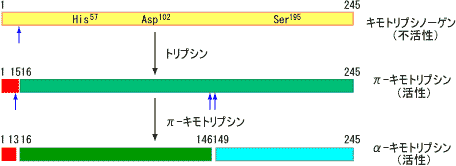
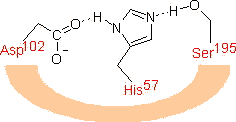
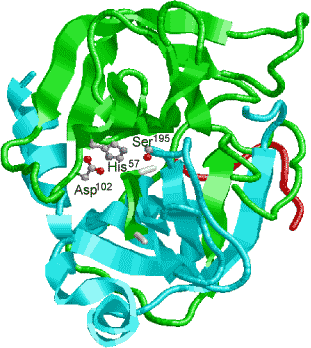
 �y�f�����̗��j
�y�f�����̗��j






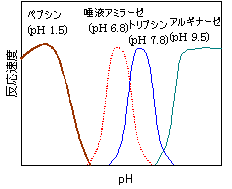
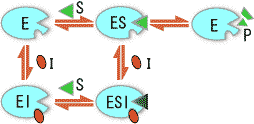
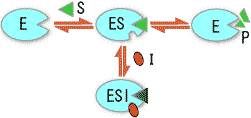
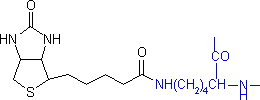 �r�I�`�j����iLys�c��Ɍ����j
�r�I�`�j����iLys�c��Ɍ����j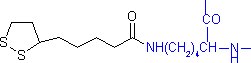 ���|�C����iLys�c��Ɍ����j
���|�C����iLys�c��Ɍ����j

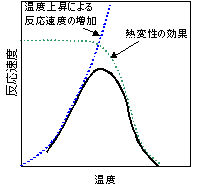
 ���K���x(optimum temperature)
���K���x(optimum temperature)