









        
|
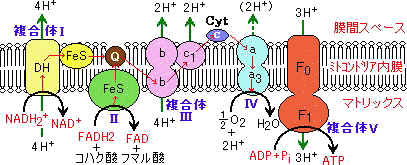
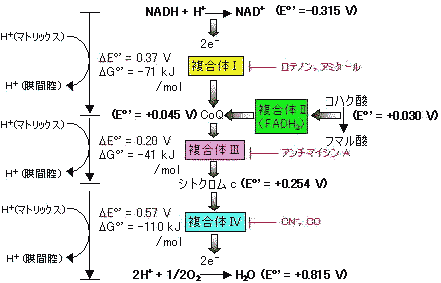
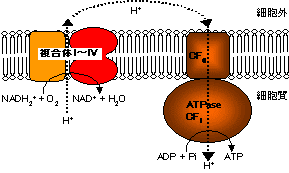
�@��TCA��H�ɂ��NADH2+��FADH2�̌`�ŕߑ����ꂽ���f�́C�~�g�R���h���A�̃N���X�e�ɂ����āC�����G�l���M�[���Ⴍ�Ȃ�悤�Ȉ�A�̍y�f�n�i������ I�`IV�j�̘A�����o�āC�ŏI��e�̂ł���_�f�iO2�j�ɓn����Đ� H2O�ɂȂ�B������ I�`IV�̒i�K�́C�~�g�R���h���A�����̃^���p�N�����y�f�Ԃœd�q�̂���肪�N����ߒ��ł��邽���d�q�`�B�n�ƌĂ��B�܂��C������ I, III, IV �̒i�K�ł́C�~�g�R���h���A�̃}�g���b�N�X���疌�ԃX�y�[�X��H+�����ݏo����C�������u�Ă����f�C�I���̔Z�x���z����������B
�@���̃v���g���iH+�j�Z�x���z�Ő����鉻�w�|�e���V�����𗘗p���āC������V�iH+�A��ATP�V���^�[�[�j��ADP�ƃ����_����ATP���������顂��̉ߒ����_���I�����_���ƌĂ�C�D�C�I��ӂ̒��S�ƂȂ�B�ȂǂŊ�������_��̓]�ڔ����ɂ����ADP����ATP��������������x���̃����_���Ƌ�ʂ����B
�@����ꂽATP�́C�~�g�R���h���A�����ɑ��݂���ADP-ATP�g�����X���P�[�^�[��ʂ��āCADP�ƌ����ɑ��₩�ɍזE���ւƉ^���i�Ό��A��,
antiport�j�
�@�����S�ߒ����ċz���irespiratory chain�j�Ƃ����B�┭�y�Ȃǎ_�f��K�v�Ƃ��Ȃ����C�I�ȑ�ӂ����s��Ȃ��C���C����(anaerobe)�ɔ�ׂāCTCA��H �ċz���𗘗p�ł����D�C����(aerobe)�͂�葽���̃G�l���M�[���l�����邱�Ƃ��ł���i�O���R�[�X�̊��S������Q�Ƃ���j�B
�ċz���𗘗p�ł����D�C����(aerobe)�͂�葽���̃G�l���M�[���l�����邱�Ƃ��ł���i�O���R�[�X�̊��S������Q�Ƃ���j�B
  
|
 |
 [�|�[���� (porin)�̗��̍\��] ���ʐ}�i���j�Ɛ^�ォ��̐}�i�E�j |
| [�~�g�R���h���A�̖͎��}] | ���q�͂P�V�{��b-�V�[�g�ł�����傫�ȃJ�S�̌`�����Ă��� �����̌���ʂ��ĐF�X�ȕ��q���ʂ� |
  
|

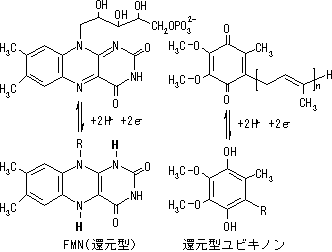 |
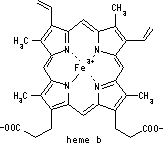
| [FMN�i�t���r���ށj�ƃ��r�L�m��(CoQ)�̎_���^�ƊҌ��^] |
| �����͐��f�Ɠd�q�̎���Ɋ֗^����B FMN�̃����_��ɃA�f�m�V���������������̂�FAD�ł���B ������I�ɂ�FMN���܂܂�CNADH2+�̐��f�Ɠd�q�����B ���r�L�m���͕�y�fQ(CoQ)�ƌĂ�C������I��II����̐��f�� �d�q�����B |
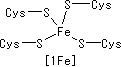 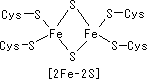 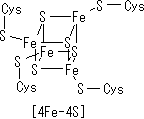 |
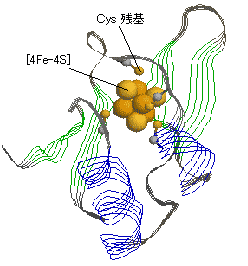 |
| [[�S�|�����N���X�^�[(Fe-S)] | 4Fe-4S]�^�^���p�N��(Fe-S)�̗� |
| ���@�̓S�C�I��(Fe2+/Fe3+)�Ɨ������C�I��(S2-)����Ȃ���̂ō\�������B�S�C�I���̓V�X�e�C���c�����ă^���p�N���Ɍ������Ă���B | [4Fe-4S]�N���X�^�[�̓^���p�N���̓����ɖ�����Ă���B |

 |
 |
< |
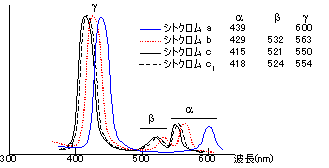 |
| [�V�g�N�����ނ̋z���X�y�N�g��] |
| �V�g�N�����ɂ͓����I��3�̋z���s�[�Na, b, g (soret��)������B |
  
|
| �@ | �y�f�� �m�����n | kDa | Subunits |
|---|---|---|---|
| ������I | NADH-��y�fQ���_�N�^�[�[ �@FMN, (Fe-S)N-1a, (Fe-S)N-1b, (Fe-S)N-2, �@(Fe-S)N-3,4, (Fe-S)N-5,6 |
1000 | 42 |
| ������II* | �R�n�N�_-��y�fQ���_�N�^�[�[ �@FAD, (Fe-S)S-1, (Fe-S)S-2, (Fe-S)S-3, �@�V�g�N����b-560 |
127 | 5 |
| ������III | ��y�fQ-�V�g�N����c�I�L�V�h���_�N�^�[�[ �@�V�g�N����bK, �V�g�N����bT, (Fe-S), �@�V�g�N����c1 |
280 | 11 |
| ������IV | �V�g�N�����I�L�V�_�[�[ �@�V�g�N����a, CuA, CuB, �V�g�N����a3 |
400 | 13 |
| ������V | ATP �V���^�[�[ �@F0�FDCCD-�����^���p�N���� �@F1�Fa3b3gde |
380 | 12-14 |
 |
| [�ċz���̑S�̑�] |
| �@������I����IV�܂ł̉ߒ����d�q�`�B�n�ł���B�}�̐Ԃ��א���2�̓d�q�̗���������Ă��顕����̇T�C�V�C�W�ō��v�P�O��H+�������̂̌��Ԃ�ʂ��Ė��ԃX�y�[�X�։^���B �@������IV��2��H+�����ԃX�y�[�X���ݏo�����悤�ɏ����Ă���̂́C�}�g���b�N�X����2��H+��������̂ŁC��������2��H+���}�g���b�N�X�����疌�ԃX�y�[�X���ݏo���ꂽ�̂Ɠ������ʂ�^���邩��ł���B |
  
|
 �d�q�`�B�n�̍\�������ƕW���Ҍ��d��
�d�q�`�B�n�̍\�������ƕW���Ҍ��d��
�@�����́i�ʖ��j �^���p�N���� Eo' (V) NADH �@ -0.315 ������I
(NADH�f�q�h���Q�i�[�[)FMN
(Fe-S)N-1a
(Fe-S)N-1b
(Fe-S)N-2
(Fe-S)N-3,4
(Fe-S)N-5,6?
-0.380
-0.250
-0.030
-0.245
-0.270�R�n�N�_ �@ +0.030 ������II
(�R�n�N�_�f�q�h���Q�i�[�[)FAD
(Fe-S)S-1
(Fe-S)S-2
(Fe-S)S-3
�V�g�N����b560-0.040
-0.030
-0.245
+0.060
-0.080CoQ �@ +0.045 ������III
(�V�g�N����bc1)�V�g�N����bK
�V�g�N����bT
(Fe-S)
�V�g�N����c1+0.030
-0.030
+0.280
+0.215�V�g�N����c �@ +0.235 ������IV
(�V�g�N����c�I�L�V�_�[�[)�V�g�N����a
CuA
CuB
�V�g�N����a3+0.210
+0.245
+0.340
+0.385O2 �@ +0.815
 �d�q�`�B�̔���
�d�q�`�B�̔���������I
|
||||||||||||||
������II
|
||||||||||||||
������III
|
||||||||||||||
������IV
|
||||||||||||||
| �}���̒��F�����̓~�g�R���h���A�����ŋ��łɌ������������̐�����\���B | ||||||||||||||
 |
 ������I
������I ������II
������II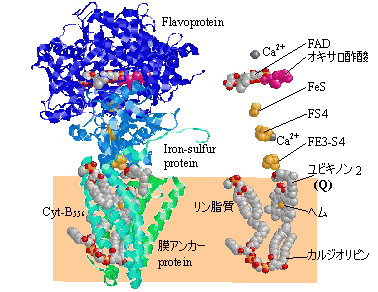
 ������III
������III
  �\�� 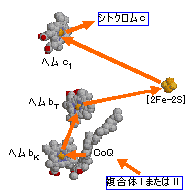 |
 |
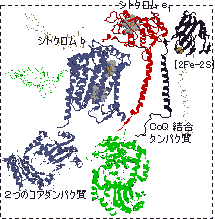
| ��F�̖��͓d�q�̈ړ�������\���B | [������III�̍\���Ɠd�q�̈ړ�] |
 �V�g�N����c
�V�g�N����c 4 cyt c(Fe2+)
4 cyt c(Fe2+)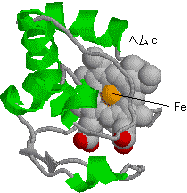 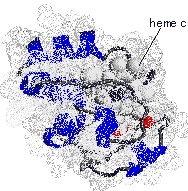 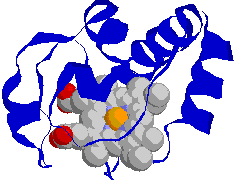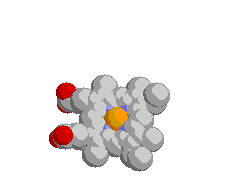 [�V�g�N����c�̍\��] |
| �w���̓^���p�N���̓����ɖ�����Ă���B |
 ������IV
������IV Fe2+��Cu2+ + e-
Fe2+��Cu2+ + e-  Cu+�̕ω��𗘗p���Ă���B
Cu+�̕ω��𗘗p���Ă���B
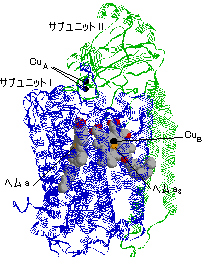 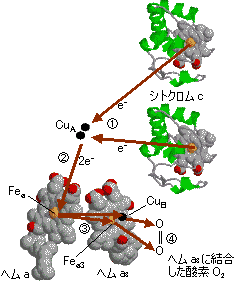 |
| [�V�g�N����c�I�L�V�_�[�[�i������IV�j�̍�p�@�\] |
| �Ԃ��������́C2�̓d�q�̗���������B |
 ������IV�̍�p�@�\
������IV�̍�p�@�\
 --������V (H+�A��ATP�V���^�[�[�j�ɂ��ATP����-- --������V (H+�A��ATP�V���^�[�[�j�ɂ��ATP����-- |
  |

 |
 |
|
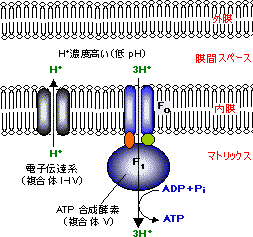
| [�_���I�����_���̖͎��}] | [�ċz���̕�����V (ATP�����y�f�CH+-ATPase)�̃��f���}] | |
| �d�q�`�B�n�̉ߒ��Ń}�g���b�N�X�����疌�ԃX�y�[�X���ݏo���ꂽH+�́CATP�����y�f�����̂�Fo��ʂ��ă}�g���b�N�X���ɓ���B���̔Z�x���z�̉����i���G���S���ω��j�̎��R�G�l���M�[�𗘗p���āCATP�����y�f�����̂�F1�iATP�����y�f�j��ADP�ƃ����_����ATP����������B |
|
 |
���ԃX�y�[�X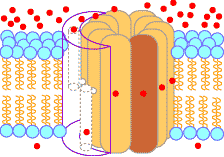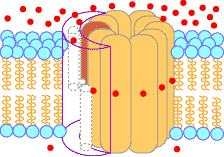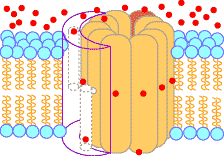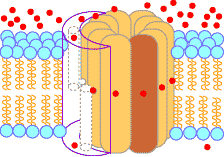 �}�g���b�N�X |
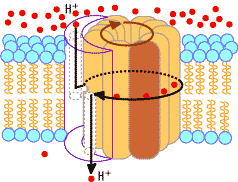
| Fo�̃T�u���j�b�ga�̓v���g����half-channel�ƂȂ��Ă���B���ԃX�y�[�X����̃v���g���̗����ŃT�u���j�b�gc10�͉�]����B10�̃v���g���̈ړ��ň��]����ƁC����ɘA������Ă���e�P��g������]��3���q��ATP�������邱�ƂɂȂ�B | [ATP�����y�f�e���̉�]�v |
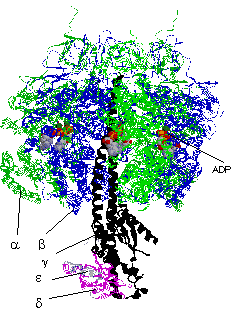  |
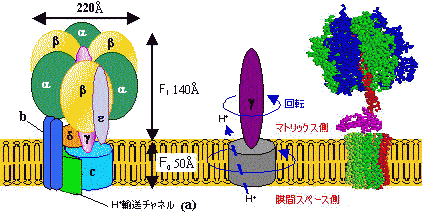
| [�E�V�S�~�g�R���h���A��ATP�����y�fF1�̗��̍\��] |
| �}�̏�����}�g���b�N�X���BF1��ab�T�u���j�b�g��6�ʑ́C���̒��S�� �т�g�T�u���j�b�g�����1����d, e�T�u���j�b�g���琬��B �eab�T�u���j�b�g�ɂ�ADP���������Ă��邪�C�G�}�������� �y�f�ł͂���ƈقȂ�B ATP���������������̂�b���ł���B �e�T�u���j�b�g�Ɍ�������6��ADP���[���Ώ̓I�ɔz�u����Ă���B6�̃T�u���j�b�g�̒������т��� ����g���͔�Ώ̓I�ŁC���ꂪ��]�����b���̗��̍\�����ω�����Bg���̉�]�ʒu�̋��3��b�� �̗��̍\���͂��ꂼ��قȂ�B�܂��Ce����ATP�����\�����^���p�N���ŁC�}�ł͋���̍\���ŏ�����Ă��邪�CATP�������ɂ͗��̍\�����傫���ω����C�c���̃R���t�H���[�V�����ɂȂ�B |

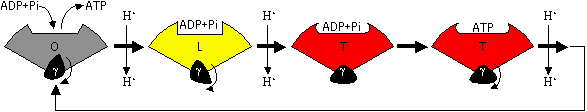 |
| [�G�}�T�u���j�b�g�̗��̍\���ω���ATP�����@�\] |
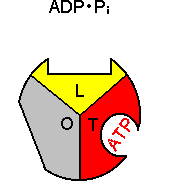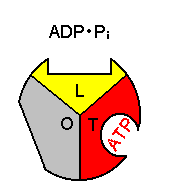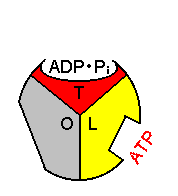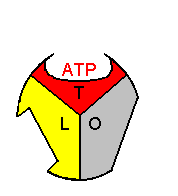 �T�u���j�b�g�P������ōl����ƁC �T�u���j�b�g�P������ōl����ƁC1. H+�̈ړ��ɂ��CO��Ԃ̃T�u���j�b�g��L��Ԃɕω�����B 2. ��ɑ���e�a�����������CADP��Pi����������B 3. 2�ڂ�H+�̈ړ��ɂ��CL��Ԃ̃T�u���j�b�g��T��Ԃɕω�����B 4. �����e�a���̃T�u���j�b�g��ŁCADP��Pi��ATP�ɕω�����B �y�f�����^(ADP + Pi)�@�@�y�f�����^(ATP + H2O)�C�@DGo = 0 ���̔����̕��t�萔�͖�1 (DGo = 0)�ł���B�]���āC���̒i�K�ɓ��ɃG�l���M�[��K�v�Ƃ��Ȃ��B �܂�CH+�̈ړ��ɂ���Đ�����G�l���M�[�͍y�f�̊������ʂƊ�Ƃ̐e�a����ω������邽�߂Ɏg���Ă��邱�� �ɂȂ�B 5. 3�ڂ�H+�̈ړ��ɂ��CT��Ԃ̃T�u���j�b�g��O��Ԃɕω�����B 6. ��Ƃ̐e�a�����������T�u���j�b�g��ATP����o����B������J��Ԃ��B |

  
|
 |
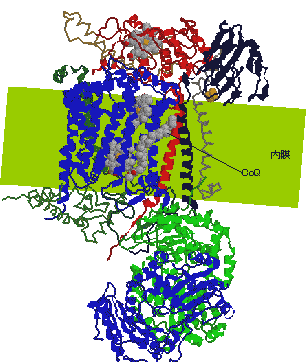
| [�咰�ۂ̌ċz��] |
 
|
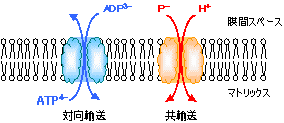 |
| �@�@[ADP-ATP�g�����X���P�[�^�[] �@[�����_�g�����X���J�[�[] |

|